高一化学。关于吸热放热的计算。 

高一化学。关于吸热放热的计算。 ![]()

最佳答案
新兵答主 04-02 TA获得超过5287个赞 2023-04-02 05:37
吸热和放热是化学反应中常见的现象。在吸热反应中,化学反应会吸收热量,使周围环境温度降低;而在放热反应中,化学反应会释放热量,使周围环境温度升高。
计算吸热或放热量的公式为:
q = m × c × ΔT
其中,q表示吸热或放热量;m表示物质的质量;c表示物质的比热容;ΔT表示温度变化量。
在实际计算中,需要注意以下几点:
1. 物质的比热容可能随温度变化而变化,需要根据实际情况选择相应的比热容值。
2. 温度变化量ΔT应该使用摄氏度为单位。
3. 如果是多步反应,需要将各步反应的吸热或放热量相加,得到总的吸热或放热量。
4. 在实际实验中,需要考虑到实验条件对反应热的影响,如压力、溶液浓度等因素。
例如,当1.00 g的水从20℃升温到100℃时,需要吸收的热量为:
q = m × c × ΔT = 1.00 g × 4.18 J/g℃ × (100℃ - 20℃) = 334 J
这表示,将1.00 g的水从20℃加热到100℃需要吸收334 J的热量。如果反应是放热反应,那么计算方法相同,只是ΔT为负值。![]()
计算吸热或放热量的公式为:
q = m × c × ΔT
其中,q表示吸热或放热量;m表示物质的质量;c表示物质的比热容;ΔT表示温度变化量。
在实际计算中,需要注意以下几点:
1. 物质的比热容可能随温度变化而变化,需要根据实际情况选择相应的比热容值。
2. 温度变化量ΔT应该使用摄氏度为单位。
3. 如果是多步反应,需要将各步反应的吸热或放热量相加,得到总的吸热或放热量。
4. 在实际实验中,需要考虑到实验条件对反应热的影响,如压力、溶液浓度等因素。
例如,当1.00 g的水从20℃升温到100℃时,需要吸收的热量为:
q = m × c × ΔT = 1.00 g × 4.18 J/g℃ × (100℃ - 20℃) = 334 J
这表示,将1.00 g的水从20℃加热到100℃需要吸收334 J的热量。如果反应是放热反应,那么计算方法相同,只是ΔT为负值。
声明:本文内容由互联网用户自发贡献自行上传,本网站不拥有所有权,未作人工编辑处理,也不承担相关法律责任。如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@bkw.cn 进行举报,并提供相关证据,工作人员会在5个工作日内联系你,一经查实,本站将立刻删除涉嫌侵权内容。
推荐视频
- 暂无问答
新高一预科班真的很重要吗
caenkai·2020-03-12英语单词问题。你们觉得拓展单词量有必要背单词的用法吗?我现在高一,有人说要背,可我觉得太花时间
bubengrun·2020-03-12高一生物中基因突变,基因重组和染色体变异分别发生在细胞中什么时候必须详细,笔记用
buhangdong·2020-03-12初中入团但没转入高中有些什么影响?我初高中在同一学校,刚升高一,团费一直都在广东共青团公众号缴纳。
cenfiaosen·2020-03-12高一化学离子方程式判断正误,求答案
bengzenhao·2020-03-12孩子上高一学习压力很大,做为父母该怎样鼓励和安慰
baolaguai·2020-03-12老师您好高一学生沉迷游戏厌学该怎么办
canyouzuan·2020-03-12高一文科生,怎么做能考上中国政法大学?
bangraokang·2020-03-12急要高一地理必修一三四章练习题
changpeizong·2020-03-12高一下学期师生交流会应该向老师提什么问题?
caizongzhuan·2020-06-02
2018年云南一级建造师资格考试考务工作通知
帮考网校·2018-07-102019年一级建造师《民航机场》历年真题精选
帮考网校·2019-11-022019年一级建造师《港口与航道》章节练习题精选
帮考网校·2019-11-04吉林省2020年一建考试时间已公布!怎么报名?
帮考网校·2020-01-23速看!非全日制学历能报考一级建造师吗?
帮考网校·2019-12-312020年一级建造师《工程经济》每日一练
帮考网校·2020-03-202020年一级建造师《水利工程》历年真题精选
帮考网校·2020-04-022020年一级建造师《机电工程》每日一练0410
帮考网校·2020-04-102020年一级建造师《铁路工程》模拟试题0512
帮考网校·2020-05-122020年一级建造师《建筑工程》模拟试题0522
帮考网校·2020-05-22
- 暂无问答
热门视频
 05:35依法实施计量检定是如何的?
05:35依法实施计量检定是如何的?2023-03-29
 01:18常用机电设备单体试运行及规定的通用规定有哪些?
01:18常用机电设备单体试运行及规定的通用规定有哪些?2023-03-28
 01:13单体试运行的主要范围及目的是什么?
01:13单体试运行的主要范围及目的是什么?2023-03-28
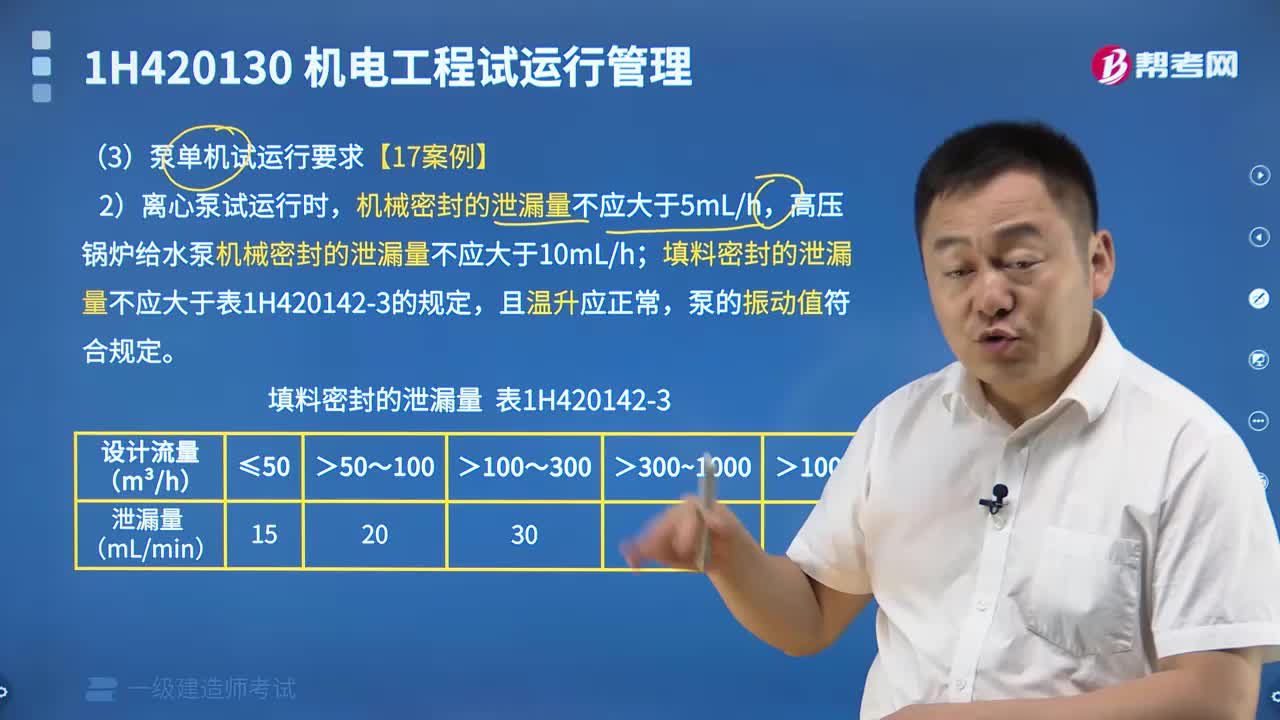 04:14泵单机试运行要求都有什么?
04:14泵单机试运行要求都有什么?2023-03-28
 01:44单体试运行前必须具备的条件有什么?
01:44单体试运行前必须具备的条件有什么?2023-03-28
互动交流

微信扫码关注公众号
获取更多考试热门资料